化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,能将还原为。25℃时,反应进行10,溶液的由7变为12。
①的结构式为。
②上述反应的离子方程式为,其平均反应速率为。
③还原过程中可生成中间产物,写出3种促进水解的方法。
(2)电化学降解的原理如图所示。
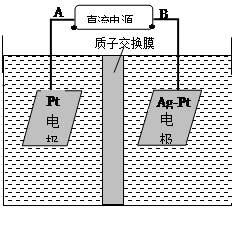
①电源正极为(填或),阴极反应式为。
②若电解过程中转移了2电子,则膜两侧电解液的质量变化差(Δ左-Δ右)为。
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,能将还原为。25℃时,反应进行10,溶液的由7变为12。
①的结构式为。
②上述反应的离子方程式为,其平均反应速率为。
③还原过程中可生成中间产物,写出3种促进水解的方法。
(2)电化学降解的原理如图所示。

①电源正极为(填或),阴极反应式为。
②若电解过程中转移了2电子,则膜两侧电解液的质量变化差(Δ左-Δ右)为。