(1)1 mol丙酮酸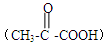 在镍催化剂作用下加1 mol 氢气转变成乳酸,乳酸的结构简式是 。
在镍催化剂作用下加1 mol 氢气转变成乳酸,乳酸的结构简式是 。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式
(3)B的甲酯可以发生加聚反应,聚合物的结构简式是
(1)1 mol丙酮酸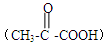 在镍催化剂作用下加1 mol 氢气转变成乳酸,乳酸的结构简式是 。
在镍催化剂作用下加1 mol 氢气转变成乳酸,乳酸的结构简式是 。
(2)与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式
(3)B的甲酯可以发生加聚反应,聚合物的结构简式是