化学小组的同学设计了下图所示装置,用以探究碱的有关性质。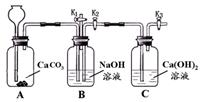
(1)打开K1关闭K2,从长颈漏斗加入足量稀盐酸,A中发生反应的化学方程式为 。
(2)一段时间后,关闭K1,打开K2和K3,C中发生反应的化学方程式为 。该过程中观察到的现象是 。
(3)小组同学预想的部分现象没有出现,可能与装置的气密性不好有关,检查该装置气密性的方法是 。
化学小组的同学设计了下图所示装置,用以探究碱的有关性质。
(1)打开K1关闭K2,从长颈漏斗加入足量稀盐酸,A中发生反应的化学方程式为 。
(2)一段时间后,关闭K1,打开K2和K3,C中发生反应的化学方程式为 。该过程中观察到的现象是 。
(3)小组同学预想的部分现象没有出现,可能与装置的气密性不好有关,检查该装置气密性的方法是 。