某同学为测定10g某赤铁矿石中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题:
2Fe+3H2O;杂质不参加反应,假定每步均完全反应或吸收)。请回答有关问题: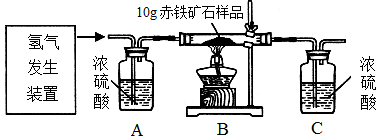
得到如下数据:
| 装置 |
B |
C |
| 反应前质量 |
84.3g |
294.1g |
| 反应后质量 |
81.9g |
296.8g |
(1)请计算该赤铁矿石样品中氧化铁的质量分数。(写出计算过程)
(2)该实验还可测定组成水中各元素之间的质量关系,请用表中实验数据列式表示出水中氢、氧元素的质量比为_______________________________________________(只列式,不计算);若玻璃管中的氧化铁没有完全反应,则求得水中氢、氧元素的质量比会__________(选填“偏大”、“偏小” 或“不变”)。
 2NaOH+Cl2↑+H2↑。若制得16.0g氢氧化钠,可同时得到氯气的质量是多少?
2NaOH+Cl2↑+H2↑。若制得16.0g氢氧化钠,可同时得到氯气的质量是多少?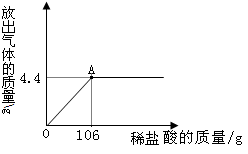
 粤公网安备 44130202000953号
粤公网安备 44130202000953号