实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题: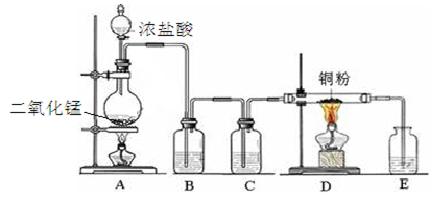
(1)写出烧瓶中发生反应的离子方程式 。
(2)B处盛有饱和食盐水(或水),其作用是 。
(3)C处盛放的试剂__________(填名称),其作用是 。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
(1)写出烧瓶中发生反应的离子方程式 。
(2)B处盛有饱和食盐水(或水),其作用是 。
(3)C处盛放的试剂__________(填名称),其作用是 。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。