右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答: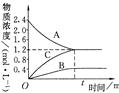
(1)该反应的反应物是 。
(2)该反应的化学方程式是: 。
(3)若达到平衡状态的时间为2min,则A的平均速率是 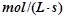 。
。
右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
(1)该反应的反应物是 。
(2)该反应的化学方程式是: 。
(3)若达到平衡状态的时间为2min,则A的平均速率是 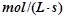 。
。