2011年“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
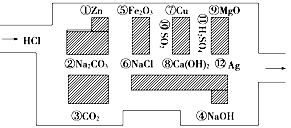
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)___________________________________________________________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有________个,属于氧化还原反应的有________个,其中能“吃掉”盐酸的盐是______________。
(3)如果将盐酸换成氯气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
____________________________________________________________________。