A~G是几种烃的分子球棍模型,据此回答下列问题: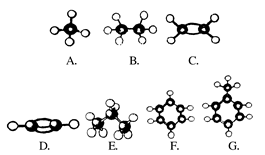
(1)常温下含碳量最高的气态烃是(填对应字母)________;
(2)能够发生加成反应的烃有(填数字)____种;
(3)一卤代物种类最多的是(填对应的字母)____;
(4)写出C发生加聚反应的化学方程式________________;
(5)写出G合成烈性炸药(TNT)的化学方程式____________。
A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)常温下含碳量最高的气态烃是(填对应字母)________;
(2)能够发生加成反应的烃有(填数字)____种;
(3)一卤代物种类最多的是(填对应的字母)____;
(4)写出C发生加聚反应的化学方程式________________;
(5)写出G合成烈性炸药(TNT)的化学方程式____________。