铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼胶KNO3的U形管)构成一个原电池,如图: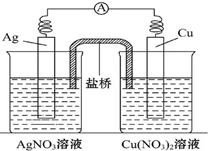
以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-====Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼胶KNO3的U形管)构成一个原电池,如图:
以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-====Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |