有下列各组物质
| A.O2和O3 |
| B.12C和14C |
C.CH3—CH2—CH2—CH3和 |
D.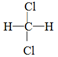 和 和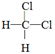 E.甲烷和庚烷 E.甲烷和庚烷 |
(1)_________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;
(4)_________组两物质互为同分异构体;
(5)_________组中两物质是同一物质。
有下列各组物质
| A.O2和O3 |
| B.12C和14C |
C.CH3—CH2—CH2—CH3和 |
D. 和 和 E.甲烷和庚烷 E.甲烷和庚烷 |
(1)_________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;
(4)_________组两物质互为同分异构体;
(5)_________组中两物质是同一物质。