日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2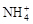 +2e-=Mn2O3+2NH3+H2O。
+2e-=Mn2O3+2NH3+H2O。
下列有关锌-锰干电池的叙述中,正确的是( )
| A.干电池中锌筒为正极,石墨棒为负极 |
| B.干电池工作时,电流方向是由锌筒经外电路流向石墨棒 |
| C.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器 |
| D.干电池可实现化学能与电能的相互转化 |
日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2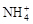 +2e-=Mn2O3+2NH3+H2O。
+2e-=Mn2O3+2NH3+H2O。
下列有关锌-锰干电池的叙述中,正确的是( )
| A.干电池中锌筒为正极,石墨棒为负极 |
| B.干电池工作时,电流方向是由锌筒经外电路流向石墨棒 |
| C.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器 |
| D.干电池可实现化学能与电能的相互转化 |