X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高。N原子外围未成对电子数是同周期中最多的。W元素的电离能数据见下表(kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
请回答:
(1)W2Y2含有的电子式为 。灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因: 。
(2)N元素基态原子的外围电子排布式是: 。
(3)X3-的空间构型是 ,中心原子的杂化方式是 。
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 。
 2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是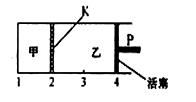

 粤公网安备 44130202000953号
粤公网安备 44130202000953号