氯气是一种重要的化工原料,在生产和生活中应用十分广泛。
已知: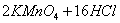 (浓)="==="
(浓)="===" 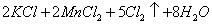 ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。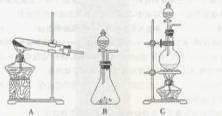
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 。(选填A或B或C)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式: 。
(3)实验室收集氯气的方法是 。
(4)常用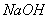 溶液吸收氯气防止污染,写出该反应的离子方程式 。
溶液吸收氯气防止污染,写出该反应的离子方程式 。
氯气是一种重要的化工原料,在生产和生活中应用十分广泛。
已知: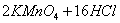 (浓)="==="
(浓)="===" 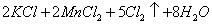 ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 。(选填A或B或C)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式: 。
(3)实验室收集氯气的方法是 。
(4)常用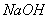 溶液吸收氯气防止污染,写出该反应的离子方程式 。
溶液吸收氯气防止污染,写出该反应的离子方程式 。