【化学 ― 选修 3 物质结构与性质】
氮的化合物在无机化工领域有着重要的地位。请回答下列问题:
(1)基态氮原子的价电子排布图为 。
(2)氮的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
(3)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气、氧化铝和碳在一定条件下反应生成CO和X (X的晶体结构如图所示),工业制备 X 的化学方程式为 。
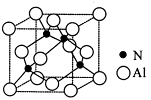
(4)X晶体中包含的化学键类型为 (填字母标号)。
(5)已知氮化硼与X晶体类型相同,且氮化硼的熔点比X高,其原因是 。
(6)若X的密度为ρg/cm3,则晶体中最近的两个Al 原子的距离为 cm (阿伏加德罗常数用 NA表示,不必化简)。