食品安全关系国计民生,影响食品安全的因素很多.下面是以食品为主题的相关问题,请根据要求回答.
聚偏二氯乙烯(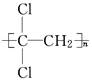 )具有超强阻隔性能,可作为保鲜食品的包装材料.它
)具有超强阻隔性能,可作为保鲜食品的包装材料.它
是由________(写结构简式)单体发生加聚反应生成的.若以乙炔为原料,通过加成反应生成1,1,2三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在上述加成反应中宜选择的加成试剂是________.(选填编号字母)
| A.HCl | B.Cl2 |
| C.HClO | D.NaCl |
食品安全关系国计民生,影响食品安全的因素很多.下面是以食品为主题的相关问题,请根据要求回答.
聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料.它
)具有超强阻隔性能,可作为保鲜食品的包装材料.它
是由________(写结构简式)单体发生加聚反应生成的.若以乙炔为原料,通过加成反应生成1,1,2三氯乙烷,再和氢氧化钠醇溶液反应可合成这种单体,则在上述加成反应中宜选择的加成试剂是________.(选填编号字母)
| A.HCl | B.Cl2 |
| C.HClO | D.NaCl |