聚苯乙烯的结构为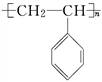 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是________________________,单体是______________________.
(2)实验测得某聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________________.
聚苯乙烯的结构为 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是________________________,单体是______________________.
(2)实验测得某聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________________.