火箭的主要燃料是“偏二甲肼”,已知该化合物由C.H、N三种元素组成, WC=40%,WH=13.33%,其分子量为60。通过结构分析可知,该物质分子中其中有一个氮原子以 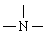 存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
(1)试推算“偏二甲肼”的分子式,并写出它的结构简式。
(2)写出燃料燃烧的热化学方程式。
火箭的主要燃料是“偏二甲肼”,已知该化合物由C.H、N三种元素组成, WC=40%,WH=13.33%,其分子量为60。通过结构分析可知,该物质分子中其中有一个氮原子以 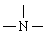 存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
(1)试推算“偏二甲肼”的分子式,并写出它的结构简式。
(2)写出燃料燃烧的热化学方程式。