某学生用下图1所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴
加试剂Y时,看到U型管中液面甲处降乙处升。关于该反应的下列叙述①该反应为放热反应;
②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量转
化为热量而释放出来。其中正确的是 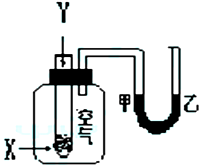
| A.①②③ | B.②③ | C.①② | D.①③ |
某学生用下图1所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴
加试剂Y时,看到U型管中液面甲处降乙处升。关于该反应的下列叙述①该反应为放热反应;
②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量转
化为热量而释放出来。其中正确的是 
| A.①②③ | B.②③ | C.①② | D.①③ |