CO2和CO是工业排放的对环境产生影响的废气。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为。
(2)科学家们提出用工业废气中的CO2制取甲醇:CO2+3H2CH3OH+H2O。制得的CH3OH可用作燃料电池的燃料。
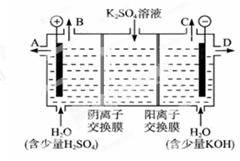
①在KOH介质中,负极的电极反应式为_________________________________。
②作介质的KOH可以用电解K2SO4溶液的方法制得。则KOH在_______出口得到,阳极的电极反应式是:_____________________________________。
(3)利用CO与H2反应可合成CH3OCH3。
已知:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
在一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是.
| A.低温高压; |
B.加入催化剂; |
C.体积不变充入氦气; |
D.增加CO的浓度;E.分离出二甲醚 |
(4)CH3OCH3也可由CH3OH合成。已知反应2CH3OH(g)  CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g),在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
物质
|
CH3OH
|
CH3OCH3
|
H2O
|
浓度/(mol·L-1)
|
0.01
|
0.2
|
0.2
|
①0-10 min内反应速率v(CH3OH) = 。
②该温度下的平衡常数为。
③若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:
v正v逆 (填“>”、“<”或“=”)。