铁铝合金是一种新型高温结构材料。
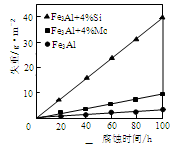
(1)图9表示室温时不同组份的Fe3Al在65%浓HNO3 中的腐蚀情况。由图9可看出添加了 (填符号)元素的合金耐蚀性最差。
(2)高温条件下,Al和Fe2O3按一定比例混合反应可制
得Fe3Al,写出该反应的化学方程式 。
(3)某校兴趣小组欲测定另一种铁铝硅合金(Fe
xAl
ySi
z)粉末的组成。
①小明同学提出如下方案:准确称取1.46g该合金粉末,再加入足量NaOH溶液(Si+2NaOH+H
2O=Na
2SiO
3+2H
2↑),充分反应后过滤,通过测定剩余固体质量及收集到气体的体积,可计算出此合金的组成。写出Al与NaOH溶液反应的离子方程式
。
②小军同学认为该方案难以测定标准状况下气体的体积,操作不简便。于是他设计了第二种方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g。试通过计算确定此合金的组成。