已知X、Y、Z、W、M五种元素,X、Z、W在元素周期表位置如下周期表,
① ZX4+ + WX- ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
分子中质子数相等。回答下列问题: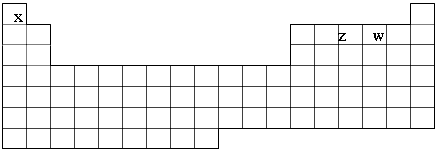
(1).在周期表中写出M,Y的元素符号;
(2).写出ZX3的化学键类型: ;
(3).写出M单质与NaOH溶液反应的离子方程式 ;
(4).M的最高价氧化物对应水化物与Z的最高价氧化物对应的水化物反应的化学方程式为: 。
已知X、Y、Z、W、M五种元素,X、Z、W在元素周期表位置如下周期表,
① ZX4+ + WX- ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
ZX3 + X2W,且反应物和产物中各微粒的电子总数与M3+相等②Z2与YW
分子中质子数相等。回答下列问题:
(1).在周期表中写出M,Y的元素符号;
(2).写出ZX3的化学键类型: ;
(3).写出M单质与NaOH溶液反应的离子方程式 ;
(4).M的最高价氧化物对应水化物与Z的最高价氧化物对应的水化物反应的化学方程式为: 。