根据下面合成路线完成有关问题: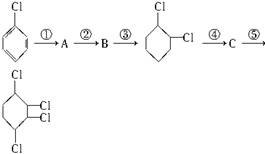
(1)写出A、B、C结构简式:A:____________,B:____________,C:____________。
(2)各步反应类型:①_________,②_________,③_________,④_________,⑤________。
(3)A→B的反应试剂及条件:____________________。
根据下面合成路线完成有关问题:
(1)写出A、B、C结构简式:A:____________,B:____________,C:____________。
(2)各步反应类型:①_________,②_________,③_________,④_________,⑤________。
(3)A→B的反应试剂及条件:____________________。