工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下: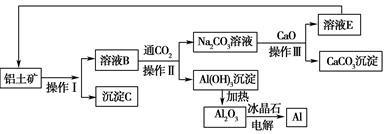
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________。
(2)写出由溶液B生成Al(OH)3的离子方程式:__________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为_____________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下:
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________。
(2)写出由溶液B生成Al(OH)3的离子方程式:__________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为_____________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。