工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g).下图表示该反应进行过程中的能量变化.
CH3OH(g).下图表示该反应进行过程中的能量变化.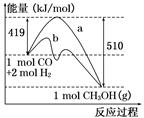
(1)曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时的能量变化,该反应是______(填“吸热”或“放热”)反应.写出该反应的热化学方程式_______________.
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g).下图表示该反应进行过程中的能量变化.
CH3OH(g).下图表示该反应进行过程中的能量变化.
(1)曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂时的能量变化,该反应是______(填“吸热”或“放热”)反应.写出该反应的热化学方程式_______________.
(2)选择适宜的催化剂________(填“能”或“不能”)改变该反应的反应热.