有4种钠的化合物,W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式
W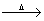 X+CO2+H2O ;Z+CO2
X+CO2+H2O ;Z+CO2 X+O2 ;Z+H2O
X+O2 ;Z+H2O Y+O2↑;X+Ca(OH)2
Y+O2↑;X+Ca(OH)2 Y+CaCO3↓。
Y+CaCO3↓。
W为 ,X为 ,Y为 ,Z为 。
有4种钠的化合物,W、X、Y、Z,根据下列反应式判断W、X、Y、Z的化学式
W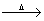 X+CO2+H2O ;Z+CO2
X+CO2+H2O ;Z+CO2 X+O2 ;Z+H2O
X+O2 ;Z+H2O Y+O2↑;X+Ca(OH)2
Y+O2↑;X+Ca(OH)2 Y+CaCO3↓。
Y+CaCO3↓。
W为 ,X为 ,Y为 ,Z为 。