如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
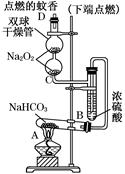
(1)在A试管内发生反应的化学方程式是___________________。
(2)B装置的作用是__________________________________。
(3)在双球干燥管内发生反应的化学方程式为_______________。
(4)双球干燥管内观察到的实验现象是__________________________
____________________________________________________________________。
上述实验现象说明________________________________________________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_________。