某同学利用下图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,,其操作可分解为如下几步:
| A.用标准溶液润洗滴定管2~3次 |
| B.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.调节液面至0或0以下刻度,记下读数 |
E. 移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度读数。
G.把锥形瓶里的溶液倒掉,用蒸馏水把锥形瓶洗涤干净。按上述操作重复一次,并记下滴定前后液面刻度的读数。
就此实验完成填空: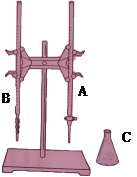
(1)上图所示是 常用的仪器,(填实验名称)。图中A是 (填仪器名称)
(2)判断到达滴定终点的实验现象是:___ ____
(3)上述E步骤操作之前,先用蒸馏水润洗锥形瓶,则对滴定结果的影响是
(填“偏高”、 “ 偏低”或“无影响”)。
(4)重复做该实验4次。所得实验数据如下表:
| 实验次数 |
c(KOH)/mol·L-1 |
B中起点刻度 |
B中终点刻度 |
V(HCl)/ml |
| 1 |
0.1000 |
0 |
24.95 |
25.00 |
| 2 |
0.1000 |
0 |
24.96 |
25.00 |
| 3 |
0.1000 |
0 |
24.50 |
25.00 |
| 4 |
0.1000 |
0 |
24.94 |
25.00 |
请你确定盐酸的物质的量浓度为 mol/L

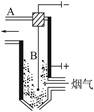
 Na2S+2CO2↑
Na2S+2CO2↑
 粤公网安备 44130202000953号
粤公网安备 44130202000953号