如图所示,容器A左侧是无摩擦、可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答: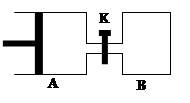
(1)A中X的转化率为 。
(2)平衡时,A、B中X转化率大小关系为A B(选填“>”、“<”、“="”" )
如图所示,容器A左侧是无摩擦、可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答: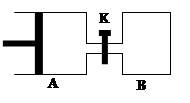
(1)A中X的转化率为 。
(2)平衡时,A、B中X转化率大小关系为A B(选填“>”、“<”、“="”" )