某学生取9g淀粉溶于水,为测定淀粉的水解百分率,其程序如图: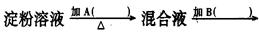

(1)各步所加试剂为:
A 、B 、C 、D 。
(2)实验中必须加B溶液的理由是 。
(3)当析出2.16g沉淀时,淀粉水解率为 。
某学生取9g淀粉溶于水,为测定淀粉的水解百分率,其程序如图: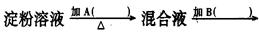

(1)各步所加试剂为:
A 、B 、C 、D 。
(2)实验中必须加B溶液的理由是 。
(3)当析出2.16g沉淀时,淀粉水解率为 。