右图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题。 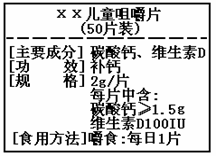
(1)主要成分碳酸钙由 种元素组成。
(2)碳酸钙中各元素的质量比为 。
(3)每片钙片中至少含钙元素的质量为 g。
(4)碳酸钙中氧元素的质量分数为 (结果精确到1%)
右图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题。 
(1)主要成分碳酸钙由 种元素组成。
(2)碳酸钙中各元素的质量比为 。
(3)每片钙片中至少含钙元素的质量为 g。
(4)碳酸钙中氧元素的质量分数为 (结果精确到1%)