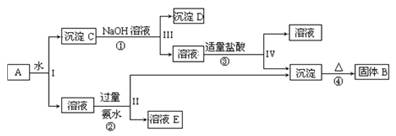
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图的反应关系,写出下列B、C、D、E所含物质的化学式
固体B ;沉淀C ;沉淀D ;溶液E 。
(3)写出①、②、③、④四个反应的化学方程式
① ;② ;③ ;④
 粤公网安备 44130202000953号
粤公网安备 44130202000953号