(1)80℃时,将0.40 mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 (g)  2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
110 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①上表中c =___________;e =_____________
②计算20s—40s内用NO2表示的平均反应速率为 mol/(L·s)
③计算在80℃时该反应的平衡常数K= ;
(2)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4,此时,平衡朝_______方向移动;建立新平衡后,N2O4的转化率_______75%(填“>、<或=”);
(3)若(1)中反应进行至110s后,保持温度和体积不变,向容器中再加入0.2mol N2O4和0.1mol NO2时,v正________ v逆(填“>、<或=”)
 CH3OH(g)
CH3OH(g)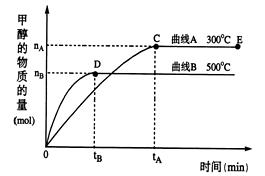
 粤公网安备 44130202000953号
粤公网安备 44130202000953号