ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替CL2来进行自来水消毒。我国最近成功研制出制取CLO2的新方法,其反应的微观过程如下所示: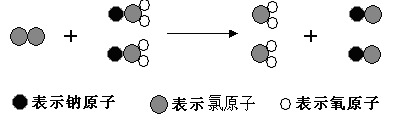
下列有关该反应的叙述中正确的是
| A.该反应是复分解反应 |
| B.该反应的化学方程式为Cl2+2NaClO2====2ClO2+2NaCl |
| C.反应中Cl2既是氧化剂,又是还原剂 |
| D.NaClO2和ClO2中Cl的化合价相同 |
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替CL2来进行自来水消毒。我国最近成功研制出制取CLO2的新方法,其反应的微观过程如下所示:
下列有关该反应的叙述中正确的是
| A.该反应是复分解反应 |
| B.该反应的化学方程式为Cl2+2NaClO2====2ClO2+2NaCl |
| C.反应中Cl2既是氧化剂,又是还原剂 |
| D.NaClO2和ClO2中Cl的化合价相同 |