甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程
|
化学方程式
|
焓变
|
活化能
|
甲烷氧化
|
|
-802.6
|
125.6
|
|
|
-322.0
|
172.5
|
蒸汽重整
|
|
206.2
|
240.1
|
|
|
165.0
|
243.9
|
回答下列问题:
(1)反应
的
=kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=;
CO(g)+3H2(g)的KP=;
随着温度的升高,该平衡常数(填"增大"、"减小"或"不变")。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于。
(5)在某一给定进料比的情况下,温度、压强对
和
物质的量分数的影响如下图:
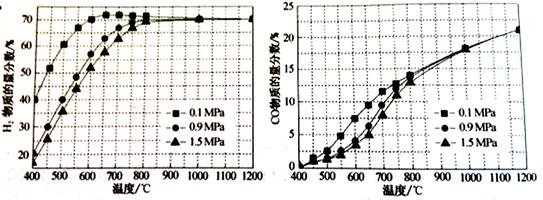
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是。
A.600℃,0.9Mpa B.
C.
D.
②画出
条件下,系统中
物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。