以海水中常见物质A为原料可以发展很多工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题。
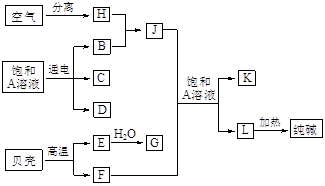
(1) C和D、C和G反应都可以制取消毒剂。C和D反应制取的消毒剂中有效成分的化学式为______ ____。H的化学式为_____ ____
(2) 电解A溶液反应的离子方程式为_________________________________。
(3) 将F和J通入A的饱和溶液中,反应的化学方程式为:
________________________________。
(4) J的空间构型为___________形。
(5)实验室可利用K与G制取J,请写出该反应化学方程式:
______________________________________________________。