用下列仪器、药品验证由铜和适量硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。已知: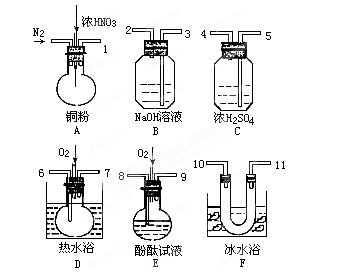
① 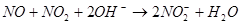
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为____。
(2)反应前先通入N2,目的是______。
(3)确认气体中含NO的现象是________。
(4)装置F的作用是________。
(5)如果O2过量,则装置B中发生反应的化学方程式为_____。
用下列仪器、药品验证由铜和适量硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。已知:
① 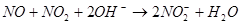
② 气体液化温度:NO2 21℃, NO -152℃
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为____。
(2)反应前先通入N2,目的是______。
(3)确认气体中含NO的现象是________。
(4)装置F的作用是________。
(5)如果O2过量,则装置B中发生反应的化学方程式为_____。