现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是 。
(2)下图是酸式滴定管中液面在滴定前后的读数: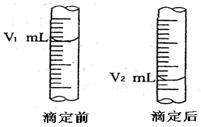
则c (NaOH) = (表达式)。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会 。(填“偏大”、“偏小”或不影响)
现用物质的量的浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,装入标准液前还应该进行的操作是 。
(2)下图是酸式滴定管中液面在滴定前后的读数:
则c (NaOH) = (表达式)。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会 。(填“偏大”、“偏小”或不影响)