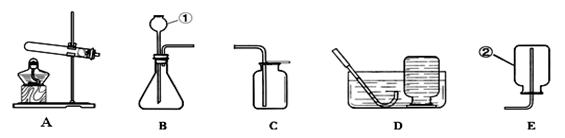
下图是实验室中用于制取气体、验证性质的装置图,请回答下列问题:


(1)用高锰酸钾制取氧气所选用的发生和收集装置是___(填字母序号,下同),反应的化学方程式为_ _。
(2)实验室制备的二氧化碳用D装置收集,则验满的方法是 。
(3)E装置利用可燃物消耗瓶内的 ,使瓶内压强减少来推测空气里氧气的含量。
(4)F实验检验甲烷的成分,将内壁一半涂澄清石灰水、一半干燥的小烧杯罩在火焰上方,观察到的实验现象是___。
(5)若从高锰酸钾制取氧气后的剩余物中回收二氧化锰(二氧化锰不溶于水),其操作步骤正确的是 。
①洗涤 ②溶解 ③干燥 ④过滤
 粤公网安备 44130202000953号
粤公网安备 44130202000953号