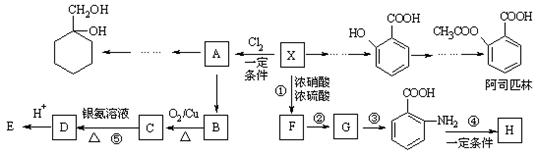
(15分)、下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式 B的电子式 。
(2)写出下列反应的化学方程式:
D+G→ H 。
F+J → B + C + I 。
(3)写出A+NaOH→D的离子方程式 。
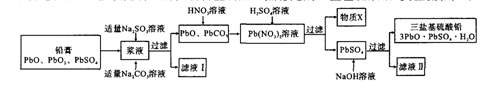
 。
。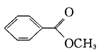 )是一种重要的工业使用的有机溶剂。分析下面的框图关系,然后回答问题:
)是一种重要的工业使用的有机溶剂。分析下面的框图关系,然后回答问题:



 键和
键和 键的个数比为。在T—Y、T—Z两种共价键中,键长较长的是。
键的个数比为。在T—Y、T—Z两种共价键中,键长较长的是。 g)
g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
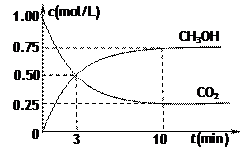
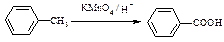
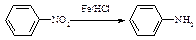 (苯胺,易被氧化)
(苯胺,易被氧化)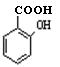 (水杨酸)有多种同分异构体,写出符合下列条件的结构简式。
(水杨酸)有多种同分异构体,写出符合下列条件的结构简式。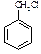 和其他无机物合成
和其他无机物合成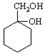 最合理的方案(不超过4步)。例:
最合理的方案(不超过4步)。例: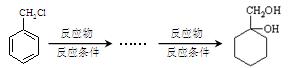
 粤公网安备 44130202000953号
粤公网安备 44130202000953号