将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图所示,符合图中情况的一组物质是( )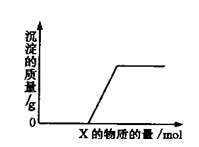
| |
X |
Y |
| A |
Ba(HCO3)2溶液 |
NaOH溶液 |
| B |
KOH溶液 |
Mg(HSO4)2溶液 |
| C |
Na2CO3溶液 |
CaCl2溶液 |
| D |
CO2气体 |
石灰水 |
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图所示,符合图中情况的一组物质是( )
| |
X |
Y |
| A |
Ba(HCO3)2溶液 |
NaOH溶液 |
| B |
KOH溶液 |
Mg(HSO4)2溶液 |
| C |
Na2CO3溶液 |
CaCl2溶液 |
| D |
CO2气体 |
石灰水 |