(6 分)课本“交流•研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol 氧气中的化学键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ 能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。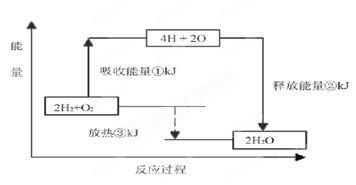
① _______________ kJ ②________________ kJ ③_________________kJ
(6 分)课本“交流•研讨”栏目有这样一组数据:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol 氧气中的化学键需要吸收249kJ的能量;形成水分子中1 molH—O键能够释放463kJ 能量。
下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在下边的横线上。
① _______________ kJ ②________________ kJ ③_________________kJ