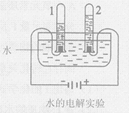
水是生命之源,也是人类最宝贵的资源。用你学过的化学知识回答下列问题:
(1)无色透明的液态水从微观角度看是由构成的。将液态水加热变成水蒸气发生的是变化(填“物理”或“化学”),而将水通电生成氢气发生的是变化(填“物理”或“化学”),这两个变化的本质区别是。
(2)节约用水、防止水污染应成为我们的自觉行为。下列有关叙述中不正确的是。
| A.生活中养成良好的用水习惯,尽可能充分利用每一滴水 |
| B.工业废水经过处理达标后再排放 |
| C.水体污染会危害人体健康 |
| D.大量使用农药、化肥,不会造成水体污染 |
(3)自然界中的水都不是纯水,净水时需加入明矾的目的是。
(4)区分软水和硬水常用的物质是。
(5)自来水属于(填“纯净物”或“混合物”); 自来水中的游离氯有少量可转变成氯离子,氯离子的符号是。
(6)某同学在完成电解水实验时,发现正极产生了10 mL气体,则负极产生的气体体积是。该实验能够说明水是由氢元素与氧元素组成的理论依据是。