已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示: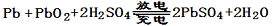
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO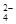 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |
已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示: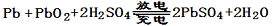
据此判断下列叙述中正确的是 ( )
A.放电时正极电极反应式PbO2 + SO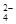 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充电时蓄电池负极应与电源正极相连接 |
| C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子 |
| D.电池放电时,溶液酸性增强 |