工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
| A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率 |
B.已知,一定温度下,反应的平衡常数(k)为定值,若向已经达到平衡状态的容器中再次加入四种物质,若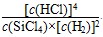 >k,平衡就要向正反应方向移动 >k,平衡就要向正反应方向移动 |
| C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收 |

 ②乙烯③C6H12O6 (葡萄糖)④CH3CH2OH
②乙烯③C6H12O6 (葡萄糖)④CH3CH2OH ⑦聚乙烯
⑦聚乙烯
 粤公网安备 44130202000953号
粤公网安备 44130202000953号