(8分) 某学生为验证苯的沸点(80.1℃)比水低,设计了如右图1所示的实验装置:(某些固定装置已略去)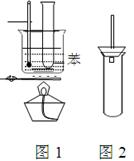
(1)该实验中能够说明苯的沸点比水低的实验现象是 。
(2)使用该实验装置的一个明显的缺点就是难以控制苯蒸气的大量外逸,有人在盛苯的试管口装上一个带有直玻璃导管的塞子(如右图2所示) ,改进后装置的直玻璃导管能防止苯蒸气的大量外逸的原因是
(3)该实验的加热方法叫 加热, 其优点是
(8分) 某学生为验证苯的沸点(80.1℃)比水低,设计了如右图1所示的实验装置:(某些固定装置已略去)
(1)该实验中能够说明苯的沸点比水低的实验现象是 。
(2)使用该实验装置的一个明显的缺点就是难以控制苯蒸气的大量外逸,有人在盛苯的试管口装上一个带有直玻璃导管的塞子(如右图2所示) ,改进后装置的直玻璃导管能防止苯蒸气的大量外逸的原因是
(3)该实验的加热方法叫 加热, 其优点是