氮是地球上含量丰富的一种元素,氮元素的
单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应
的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0,
2NH3(g) △H < 0,
其平衡常数K与温度T的关系如下表:
T/K
|
298
|
398
|
498
|
平衡常数K
|
4.1×106
|
K1
|
K2
|
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
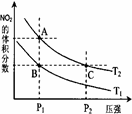
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=, 以NH3表示该过程的反应速率v(NH3)= 。