在一定温度下,对于可逆反应C(s)+H2O(g) 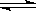 CO(g)+H2(g),其平衡常数表达式正确的是( )
CO(g)+H2(g),其平衡常数表达式正确的是( )
A.K=[c(C)·c(H2O)]/ [c(CO)·c(H2)] B.K= [c(CO)·c(H2)]/ [c(C)·c(H2O)]
C.K=[c(H2O)]/ [c(CO)·c(H2)] D.K=[c(CO)·c(H2)/ [c(H2O)]]
在一定温度下,对于可逆反应C(s)+H2O(g) 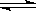 CO(g)+H2(g),其平衡常数表达式正确的是( )
CO(g)+H2(g),其平衡常数表达式正确的是( )
A.K=[c(C)·c(H2O)]/ [c(CO)·c(H2)] B.K= [c(CO)·c(H2)]/ [c(C)·c(H2O)]
C.K=[c(H2O)]/ [c(CO)·c(H2)] D.K=[c(CO)·c(H2)/ [c(H2O)]]