已知Fe2O3在高炉中有下列反应:Fe2O3+CO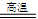 2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
(1)上述固体混合物中,m(Fe)﹕m(O)不可能是 。
A.21﹕9 B.21﹕7.5 C.21﹕6
(2)若m(Fe)﹕m(O)=21﹕8,计算Fe2O3被CO还原的百分率。
已知Fe2O3在高炉中有下列反应:Fe2O3+CO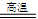 2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
(1)上述固体混合物中,m(Fe)﹕m(O)不可能是 。
A.21﹕9 B.21﹕7.5 C.21﹕6
(2)若m(Fe)﹕m(O)=21﹕8,计算Fe2O3被CO还原的百分率。