纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ
|
用炭粉在高温条件下还原CuO
|
方法Ⅱ
|
电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。
|
方法Ⅲ
|
用肼(N2H4)还原新制Cu(OH)2
|
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s)△H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g)△H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s)△H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为。
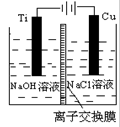
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: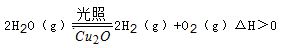
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
序号
|
温度
|
0
|
10
|
20
|
30
|
40
|
50
|
①
|
T1
|
0.050
|
0.0492
|
0.0486
|
0.0482
|
0.0480
|
0.0480
|
②
|
T1
|
0.050
|
0.0488
|
0.0484
|
0.0480
|
0.0480
|
0.0480
|
③
|
T2
|
0.10
|
0.094
|
0.090
|
0.090
|
0.090
|
0.090
|
下列叙述正确的是(填字母代号)。
A.实验的温度T2小于T1
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高