在潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用于制取氧气。
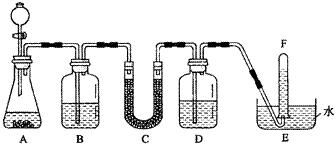
(1)A是用CaCO3制取CO2的装置。写出A中发生反应的化学方程式:
。
(2)按要求填写表中空格:
仪器编号
|
盛放的试剂
|
加入该试剂的目的
|
B
|
饱和NaHCO3溶液
|
|
C
|
|
与CO2反应,产生O2
|
D
|
|
吸收未反应的CO2气体
|
(3)为了达到实验目的,(填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;若你认为需要增加一个吸收水蒸气装置,应选用作为吸水剂;若你认为不需要,请说明理由是。
(4)证明收集到的气体是氧气的方法是。